
واکنش های شیمیایی فرآیندهایی هستند که در آنها نوعی از ماده شیمیایی به نوعی دیگر تبدیل می شود. به طور کلی شامل تغییراتی می شود که در آن فقط موقعیت الکترون ها در تشکیل و شکستن پیوندهای شیمیایی بین اتم ها تغییر می کند بدون اینکه تغییری در موقعیت هسته ایجاد شود. ماده یا موادی که در ابتدا درگیر واکنش های شیمیایی می شوند، واکنش دهنده یا معرف نامیده می شوند.
محصولات حاصل از واکنش شیمیایی دارای خصوصیاتی متفاوت از مواد اولیه خواهند بود. این واکنش ها معمولا با معادلاتی نشان داده می شوند هر معادله شیمیایی شامل مواد اولیه، محصولات و در برخی موارد حد واسط می باشد.
هر واکنشی با سرعت و غلظت مشخصی انجام می گیرد. معمولا افزایش دما منجر به افزایش سرعت واکنش می شود چرا که در اثر افزایش دما میزان جنبش مولکولی افزایش می یابد و احتمال برخورد مولکول ها و در نتیجه انجام واکنش شیمیایی بیشتر می شود. این واکنش ها ممکن است بصورت پیش رونده و یا بازگشتی (معکوس) باشد تا زمانیکه کامل شوند و یا به تعادل برسند.

معادله (فرمول) واکنش شیمیایی
معادلات شیمیایی به منظور توصیف یک واکنش شیمیایی استفاده می شود. آن ها شامل مواد شیمیایی با فرمول ساختاری واکنش دهنده ها در سمت چپ و محصولات در سمت راست معادله می باشند و معمولا با یک پیکان از هم جدا می شوند. نوع پیکان تعیین کننده این است که آیا واکنش کامل (→) و یا تعادلی (⇌) است. تعداد اتم ها در سمت چپ معادله باید با تعداد اتم ها در سمت راست معادله برابر باشد. تعداد اتم ها را با ضرایب استوکیومتری نشان می دهیم. به عنوان مثال در معادله زیر A و B واکنشگر، C و D محصول و a,b,c,d ضرایب استوکیومتری اتم ها هستند.
aA + bB → cC + dD
واکنش کامل چیست؟
دو نوع واکنش شیمیایی وجود دارد: واکنش کامل و تعادلی.
- واکنش کامل: در این نوع واکنش، واکنشگرها به طور کامل مصرف شده و به محصول تبدیل می شوند. برگشت ناپذیر و یک طرفه هستند.
- واکنش تعادلی: واکنشی است که که در آن فعالیت شیمیایی و در نتیجه غلظت مواد اولیه و محصولات با گذشت زمان تغییر نکند. معمولا این نوع واکنش ها برگشت پذیرند.
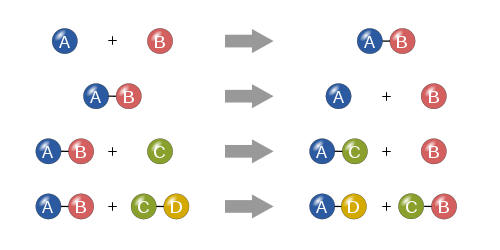
انواع واکنش های شیمیایی
دسته بندی ها مختلفی برای واکنش های شیمیایی وجود دارد اما یک تقسیم بندی اساسی، واکنش های شیمیایی را به پنج دسته تقسیم می کند: واکنش های ترکیبی (Combination reactions)، واکنش های تجزیه ای (Decomposition reactions)، واکنش جانشینی یگانه (Single-Replacement reactions)، واکنش جانشینی دوگانه (Double-Replacement reactions) و واکنش های سوختن (احتراق) (Combustion reaction).
با تجزیه و تحلیل واکنش دهنده ها و محصولات واکنش را می توان در یکی از این گروه ها قرار داد و برخی واکنش ها در بیش از یک گروه قرار می گیرد. در ادامه به بررسی انواع واکنش های شیمیایی نام برده خواهیم پرداخت.
1-واکنش های ترکیبی
این واکنش که با نام سنتزی نیز شناخته می شوند، واکنشی است که در آن دو یا چند ماده با هم ترکیب می شوند و یک ماده واحد جدید تشکیل می دهند. فرم کلی آن به صورت زیر است:
A + B → AB
در این نوع واکنش، دو عنصر با هم ترکیب می شوند و یک ترکیب را تکشیل می دهد. به عنوان مثال از ترکیب عناصر سدیم و کلر، نمک سدیم کلرید تشکیل می شود.
2Na (s) + Cl2 (g) → 2NaCl (s)
برای نوشتن معادله موازنه شده، به یاد داشته باشید که هفت عنصر هستند که به طور طبیعی به صورت مولکول های دو اتمی وجود دارند که شامل H2, N2, O2, F2, Cl2, Br2, I2است. یک نوع واکنش ترکیبی که به طور مکرر اتفاق می افتد ، واکنش یک عنصر با اکسیژن برای تشکیل اکسید عنصر است. فلزات و غیر فلزات به راحتی با اکسیژن واکنش می دهند. منیزیم با احتراق سریع و چشمگیر واکنش می دهد و با اکسیژن هوا ترکیب شده و پودری از اکسید منیزیم تولید می کند.
2Mg (s) + O2 (g) → 2MgO (s)

2-واکنش تجزیه ای
یک واکنش تجزیه ای واکنشی است که در آن ترکیبی به دو با چند جز شکسته می شود. اکثر واکنش های تجزیه ای برای انجام نیاز به انرژی اولیه مانند گرما، نور یا برق دارند. فرم کلی این واکنش به صورت زیر است:
AB → A + B
ترکیبات دو عنصره ترکیباتی هستند که فقط از دو عنصر تشکیل شده اند. ساده ترین نوع واکنش تجزیه زمانی است که یک ترکیب دو عنصری به عناصر آن تجزیه می شود. اکسید جیوه یک جامد قرمز رنگ است که با گرم شدن تجزیه می شود و گاز جیوه و اکسیژن تولید می کند.
2HgO (s) → 2Hg (l) + O2 (g)
همچنین تجزیه یک ترکیب به چند ترکیب ساده تر نیز در دسته واکنش های تجزیه ای قرار می گیرد. به عنوان مثال تجزیه کربنات فلزات به اکسید فلز و گاز دی اکسید کربن یک واکنش تجزیه ای است.
CaCO3 (s) → CaO (s) + CO2 (g)
هیدروکسیدهای فلزی در اثر حرارت تجزیه می شوند و باعث تولید اکسیدهای فلزی و آب می شوند. به عنوان مثال هیدروکسید سدیم تجزیه می شود و اکسید سدیم و آب تولید می کند.
2NaOH (s) → Na2O (s) + H2O (g)
بیشتر بخوانید: روش های جذب و جداسازی دی اکسید کربن
3-واکنش جانشینی یگانه
واکنش جانشینی یگانه واکنشی است که در آن یک عنصر جایگزین عنصر مشابه در یک ترکیب می شوند. شکل کلی واکنش جایگزینی یگانه به صورت زیر است. در این واکنش عنصر A که یک فلز است، جایگزین عنصر B ،که آن نیز یک فلز است، در ترکیب می شود.
A + BC → AC + B
زمانیکه عنصر یک نافلز باشد باید جایگزین یک نافلز دیگر شود که آن را نیز به طور کلی به صورت زیر نشان می دهند. در این معادله Y یک نافلز است و با Z نافلز در ترکیب با X جایگزین می شود.
Y + XZ → XY + Z
به مثال زیر توجه کنید. منیزیوم عنصری است که از مس بسیار فعال تر است. وقتی که نواری از فلز منیزیوم در محلول آبی نیترات مس قرار می گیرد، منیزیوم جایگزین مس می شود. محصول واکنش نیترات منیزیوم و فلز مس خواهد بود.
Mg (s) + Cu(NO3)2 (aq) + Cu (s)
بسیاری از فلزات به راحتی با اسیدها واکنش می دهند، که در این واکنش ها معمولا یکی از محصولات گاز هیدروژن است. به عنوان مثال روی با هیدروکلریک اسید واکنش می دهد و محلول آبی کلرید روی و هیدروژن تولید می کند.
Zn (s) + 2HCl (aq) → ZnCl2 (aq) + H2 (g)

4-واکنش جایگزینی دوگانه
واکنش جانشینی دوگانه، واکنشی است که در آن یون های مثبت و منفی دو ترکیب یونی جانشین یکدیگر شده و دو محصول جدید تولید می شود. فرم کلی این واکنش بصورت زیر است. در این واکنش A و C کاتیون هایی با بار مثبت، و B و D آنیون هایی با بار منفی هستند.
AB + CD → AD + CB
به طور کلی یک واکنش جانشینی دوگانه بین دو جز در محلول آبی اتفاق میفتد. برای انجام این واکنش، یکی از محصولات معمولا رسوب جامد، گاز، و یا یک ترکیب مولکولی مانند آب است. رسوب زمانی تشکیل می شود که واکنش جانشینی دوگانه بین فرم کاتیونی یک واکنشگر در ترکیب با فرم آنیونی واکنشگر دیگر انجام شود و یک ترکیب نامحلول یونی تشکیل شود. زمانیکه محلول آبی پتاسیم یدید و سرب (ll) نیترات مخلوط می شوند، در نتیجه واکنش جانشینی دوگانه رسوب سرب (ll) یدید ایجاد می شود.
2KI (aq) + Pb(NO3)2 (aq) → 2KNO3 (aq) + PbI2 (s)
5-واکنش سوختن
واکنشی است که در آن یک ماده با گاز اکسیژن واکنش داده و انرژی از نوع نور و گرما آزاد می کند. واکنش سوختن باید O2 را به عنوان واکنش دهنده درگیر کند. سوختن گاز هیدروژن منجر به تولید بخار آب می شود.
2H2 (g) + O2 (g) → 2H2O (g)
بسیاری از واکنش های سوختن با هیدروکربن رخ می دهد، ترکیبی که فقط از کربن و هیدروژن ساخته شده است. محصول سوختن هیدروکربن ها همواره دی اکسید کربن و آب است. بسیاری از این هیدروکربن ها به عنوان سوخت استفاده می شود زیرا با سوختن آن ها مقدار زیادی انرژی گرمایی آزاد می شود. به عنوان مثال پروپان هیدروکربن گازی است که به عنوان منبع سوخت در کوره های گازی استفاده می شود.
C3H8 (g) + 5O2 (g) → 3CO2 (g) + 4H2O (g)

تمایل ماده به شرکت در واکنش های شیمیایی در جدول تناوبی
واکنش پذیری به معنای توانایی عناصر به شرکت در واکنش های شیمیایی است. همانطور که گفته گفت واکنش شیمیایی به معنای تبادل الکترون بین عناصر است. بنابراین واکنش پذیری به توانایی عنصر در دادن و یا گرفتن الکترون نسبت داده می شود.
در جدول تناوبی فلزات تمایل به از دست دادن الکترون و نافلزات تمایل به گرفتن الکترون دارند. با این توصیف، در یک گروه جدول تناوبی خاصیت فلزی از بالا به پایین افزایش یافته و میزان واکنش پذیری آن افزایش می یابد. طبق قاعده اوکتت، اتم ها تمایل به تکمیل لایه ظرفیت خود و رسیدن به آرایش الکترونی گاز نجیب دوره خود دارند.
با توجه به این مطلب فلزات قلیایی واکنش پذیرترین فلزات و پس از آن فلزات قلیایی خاکی در رتبه دوم قرار دارند. همچنین هرچه شعاع اتمی افزایش یابد میزان گزینش پذیری افزایش می یابد. به همین جهت در هر گروه از بالا به پایین و در هر ردیف از چپ به راست شعاع افزایش یافته و میزان واکنش پذیری افزایش می یابد.
چند نمونه واکنش شیمیایی
در ادامه چند نمونه از واکنش های شیمیایی که بیشتر مورد توجه است را مورد بررسی قرار خواهیم داد:
واکنش زنگ زدن آهن
واکنش زنگ زدن آهن ترکیبی از واکنش های سوختن (اکسایش) و ترکیبی است. در حضور آب و اکسیژن رخ می دهد. به علت متغیر بودن تعداد مولکول های آب، آن را با x نشان می دهند.
4Fe + O2 + (4+2x)H2O → 2Fe2O3.xH2O + 8H

واکنش سوختن متان
همانطور که پیش از این ذکر شد، در سوختن هیدروکربن ها همواره آب و دی اکسید کربن محصول نهایی است. متان نیز یک هیدروکربن ساده است که در گاز طبیعی موجود است و معادله سوختن آن به صورت مقابل است:
CH4 + 2O2 → CO2 + 2H2O
واکنش سوختن گلوکز
گلوکز ترکیبی است که در بدن ما به وجود دارد و واکنش سوختن (اکسایش) آن به صورت زیر است:
C6H12O6 + 6O2 → 6CO2 + 6H2O





