
یکی از مفاهیمی که در شیمی به منظور بیان غلظت استفاده می شود نرمالیته است. این مفهوم معمولا به عنوان معیاری برای اندازه گیری گونه های واکنش پذیر در محلول و همچنین بیان غلظت در واکنش های تیتراسیون اسید-باز مورد استفاده قرار می گیرد. نرمالیته را با N نشان می دهند. بر اساس تعریف، به تعداد گرم حل شده یا مول اکی والان یک ترکیب در هر لیتر محلول گفته می شود.
یک لیتر محلول/ تعداد مول اکی والان یا گرم یک ترکیب = نرمالیته
در واقع نرمالیته به معنای محاسبه تعداد ذرات فعال در یک محلول است. بنابراین تعریف دقیق تر نرمالیته به صورت زیر است:
تعریف: به تعداد اکی والان های حل شده در یک لیتر محلول گفته می شود. واحد آن اکی والان بر لیتر (eq/L) یا میلی اکی والان بر لیتر (meq/L) است که واحد دوم معمولا در نمونه های پزشکی مورد استفاده قرار می گیرد. اما برای درک بهتر این موضوع بایستی با مفهوم اکی والان آشنا شویم. هر اکی والان تعداد گرم های از یک ماده است که معادل یک گرم هیدروژن می باشد.
چگونه نرمالیته را محاسبه کنیم؟
در این زمینه نکاتی وجود دارد که اگر رعایت شود، محاسبه را بسیار آسان خواهد کرد. برای محاسبه ایتدا باید وزن مولکولی نمونه مورد نظر را به دست آورید. این کار را می توان با کمک کتاب های مرجع و همچنین یک جستجوی ساده در اینترنت انجام داد. در مرحله بعد باید تعداد گرم اکی والان حل شونده را به دست آورید که در ادامه چگونگی آن را توضیح خواهیم داد. مرحله سوم دانستن حجم محلول مورد نظر است. و در نهایت آخرین مرحله محاسبه نرمالیته با استفاده از فرمول و جایگزینی مقادیر محاسبه شده است.
فرمول های نرمالیته
برای محاسبه نرمالیته فرمول های متفاوتی وجود دارد. اما کامل ترین و جامع ترین آن به صورت زیر است:
N=C/E
N: نرمالیته، C: مقدار گرم های حل شونده در یک لیتر محلول، E: اکی والان
E=m/n
E: اکی والان، m: جرم مولکولی، n: ظرفیت
N= (M*Mw)/E
M: مولاریته، Mw: جرم مولی، E: اکی والان
N=M*OH = M*H
M: جرم مولی، OH: بازیسیته، H: اسیدیته
بازیسیته و اسیدیته متناسب با تعداد H+ و OH– است که یک ترکیب می تواند در محلول آزاد کند.
روش تعیین ظرفیت (n) در فرمول اکی والان
برای محاسبه تعداد اکی والان های هر ترکیب نیاز به محاسبه ظرفیت آن است. مقدار ظرفیت برای هر ترکیبی متفاوت است. مقدار n برای هر ترکیب به صورت زیر است:
در اسیدها n تعداد یون هیدروژنی است که در آب آزاد می شود. به عنوان مثال در اسید کلریدریک چون یک هیدروژن آزاد می شود بنابراین ظرفیت آن 1 است. همچنین در اسید سولفوریک ظرفیت 2 و در اسید فسفریک 3 می باشد.
میزان ظرفیت برای بازها برابر با تعداد OH– است که یک ترکیب در آب آزاد می کند. به عنوان مثال سود (NaOH)، یک OH– می تواند آزاد کند بنابراین ظرفیت آن 1 است. همچنین ظرفیت کلسیم هیدروکسید 2 و آلومینیوم هیدروکسید 3 است.
در فلزات عدد n برابر با ظرفیت فلز است. به عنوان مثال در سدیم از آنجا که یک بار مثبت است (Na+) بنابراین ظرفیت آن 1 می باشد. همچنین کلسیم ظرفیت 2 دارد. در نافلزات نیز n برابر با ظرفیت نافلز است مانند گوگرد که ظرفیت آن 2 است.
همچنین در واکنش های اکسایش و کاهش عدد n برابر با تغییر عدد اکسایش و کاهش است. برای این موضوع به مثال زیر توجه کنید:
MnO4– + H+ + e– → Mn2+ + H2O
در این واکنش، میزان تغییر درجه اکسیداسیون منگنز از +7 به 2+ است که در نتیجه آن میزان تفاوت 5 است و این مقدار برابر با ظرفیت است.

نرمالیته و مولاریته
نرمالیته و مولاریته دو موضوع مهم در شیمی هستند که به طور گسترده ای در محلول سازی استفاده می شوند. این عبارات برای اندازه گیری های کمی ترکیبات مورد استفاده قرار می گیرند. اما چه ارتباطی میان این دو هست؟ در این بخش در این مورد صحبت خواهیم کرد. همانند نرمالیته، مولاریته نیز یکی از واحدهای بیان غلظت در شیمی است. مولاریته به عنوان تعداد مول های حل شده در هر لیتر محلول بیان می شود. این عبارت با عنوان غلظت مولی نیز بیان می شود. گاها از مولاریته برای محاسبه pH، ثابت تفکیک یا ثابت تعادل استفاده می شود. فرمول مولاریته به صورت زیر است:
حجم محلول (لیتر)/ تعداد مول های حل شونده = مولاریته
M = mol/Litre
حال بیایید ببینیم چه ارتباطی بین این دو هست. اگر به فرمول نرمالیته توجه کنیم خواهیم دید که این فرمول به نوعی حاوی مولاریته است. مولاریته اولین گام برای محاسبه حجم و غلظت است اما نرمالیته به منظور محاسبات پیشرفته تر و ایجاد رابطه یک به یک میان اسید و باز استفاده می شود. می توان برای محاسبه نرمالیته از طریق مولاریته از فرمول زیر استفاده کرد:
N = (M*Mw)/E
همچنین برای تبدیل مولاریته به نرمالیته می توان از فرمول زیر استفاده کرد:
N = n × M
کاربردهای نرمالیته
نرمالیته سه کاربرد عمده دارد:
- تعیین غلظت اسید و باز: جهت تعیین غلظت یون هیدرونیوم (H3O+) و یون هیدروکسید (OH–) در محلول
- در واکنش های رسوبی جهت اندازه گیری تعداد یون هایی که در تشکیل رسوب شرکت می کنند.
- در واکنش های اکسایش و احیا جهت تعیین تعداد الکترون هایی که یک احیا کننده یا اکسید کننده می تواند بدهد یا بگیرد استفاده می شود.
نرمالیته در تیتراسیون
همانطور که می دانید تیتراسیون یک روش تعیین غلظت است که در آن از یک تیترانت برای خنثی سازی نمونه استفاده می شود. د راین روش تغییر رنگ نشان از خنثی شدن تیتر شونده است. برای محاسبه غلظت نمونه در این روش می توان از دو مفهوم مولاریته و نرمالیته استفاده کرد. ما در این بخش قصد داریم محاسبه به کمک نرمالیته را شرح دهیم. برای محاسبه نرمالیته در یک تیتراسیون اسید- باز از فرمول زیر استفاده می شود:
N1V1= N2V2
در این فرمول:
N1: نرمالیته محلول اسیدی
V1: حجم محلول اسیدی
N2: نرمالیته محلول بازی
V2: حجم محلول بازی
مثال: اگر 25 میلی لیتر محلول اسید سیتریک با 28.12 میلی لیتر KOH 0.1718 نرمال تیتر شود، غلظت اسید سیتریک چقدر است؟
طبق فرمول گفته شده در بالا خواهیم داشت:
NaVa = NbVb
Na × 25 ml = 0.1718 N × 28.12 ml
Na = 0.1932
طبق محاسبات انجام شده، غلظت استیک اسید 0.1932 نرمال است.
فرمول دیگر برای محاسبه نرمالیته
یک فرمول که به عنوان میانبر در مسائل شیمی برای محاسبه نرمالیته استفاده می شود فرمول زیر است:
N = (10 ad)/E
در این فرمول a: درصد خلوص، d: چگالی و E: اکی والان می باشد. می توان از آن برای محاسبه مسائلی که در آن درصد خلوص بیان شده استفاده کرد.
مثال های محاسبه نرمالیته در مسائل شیمی
1- در فرمول زیر نرمالیته محلول 1 مولار H3PO4 را محاسبه کنید.
H3AsO4 + 2 NaOH → Na2HAsO4 + 2 H2O
راه حل: برای حل این مسئله ابتدا باید نگاهی به واکنش بیندازیم. می توان دید که فقط دو تا از H+ های H3AsO4 با NaOH واکنش می دهند و محصول را تولید می کنند. بنابراین، دو تا یون برابر 2 اکی والان است. حال از فرمول گفته شده برای محاسبه استفاده می کنیم.
N = M × n
N = 1 × 2 = 2
بنابراین محلول 2 نرمال است.
2- مقدار نرمالیته 0.321 گرم کربنات سدیم را زمانیکه با 250 میلی لیتر آب مخلوط می شود محاسبه کنید.
راه حل: برای این مسئله، شما باید فرمول کربنات سدیم را بدانید. فرمول مولکولی کربنات سدیم به صورت Na2CO3 است و نشان می دهد که دو یون سدیم برای هر یون کربنات استفاده می شود. بنابراین مسئله را به این صورت حل می کنیم:

3- نرمالیته محلول های زیر را محاسبه کنید.
الف) محلول 0.1381 مولار NaOH
ب) محلول 0.0521 مولار H3PO4
راه حل:
الف) N = 0.1381 mol/L × (1 eq/1 mol) = 0.1381 eq/L
ب) N = 0.0521 mol/L × (3 eq/1 mol) = 0.156 eq/L
4- اگر برای تیتراسیون 0.1369 گرم کربنات سدیم، مقدار 21.18 میلی لیتر اسید نیاز باشد، مقدار نرمالیته اسید چقدر است؟
راه حل:
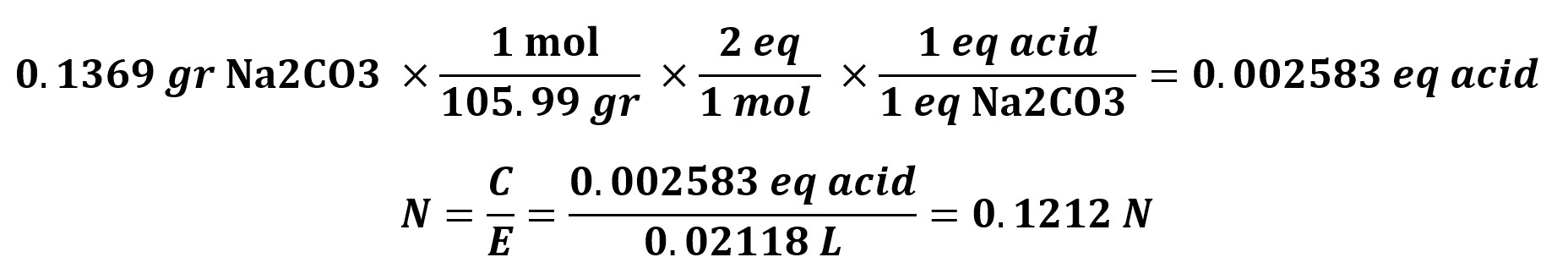
5- برای تهیه 100 میلی لیتر محلول 2 نرمال به چه مقدار کلریدریک اسید 37% نیاز است؟ چگالی اسید 1.18 گرم بر سانتی متر مکعب است.
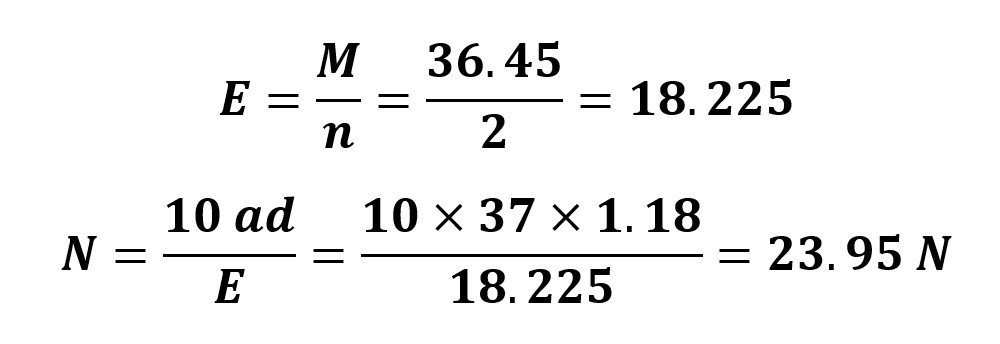
جمع بندی
در این مقاله توضیحی در مورد نرمالیته و انواع فرمول ها و روش های محاسبه آن آورده شد. با استفاده از این فرمول ها می توان نرمالیته انواع ترکیبات شامل استیک اسید، استیک اسید، آمونیاک و بسیاری دیگر از این مواد را می توان محاسبه کرد.





